ABOUT 研究室の紹介
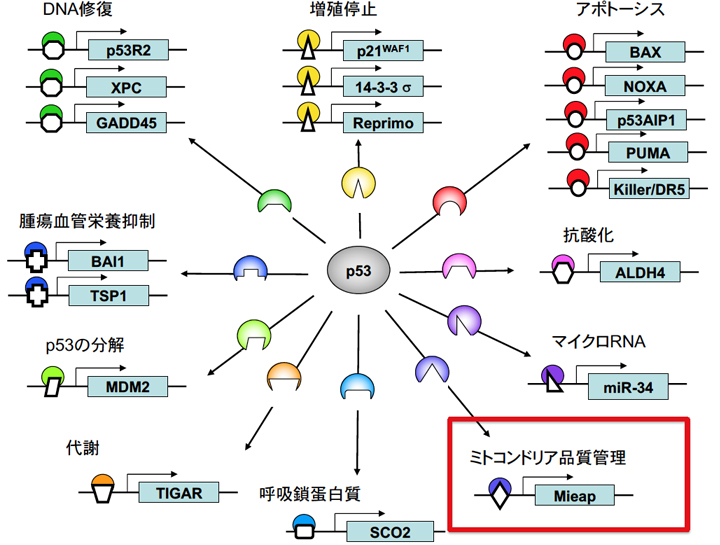
品質不良なミトコンドリアの蓄積は、ミトコンドリアの機能不全を引き起こし、がん・神経変性疾患・老化をはじめとした様々な疾患や病態の原因となる。しかしながら、ミトコンドリアの品質管理がどのように行われているかは、永らく不明であった。分野長の荒川は長年p53標的遺伝子研究に取り組み、細胞死やDNA修復、血管新生抑制などに関わる遺伝子を同定し報告してきた(Cell 2000, Nature 2000, Mol Cell 2001, Nature Cell Biol 2003, Nature Genet 2003, Nature Rev Cancer 2004, Nature Genet 2007, Cancer Res 2007)。この一連の研究の中で、最も重要なp53標的遺伝子としてMieap 遺伝子を発見し、p53のがん抑制機能として全く新しいメカニズムを発見するに至った(図1)(PLOS ONE 2011)(実験医学、2019年)。
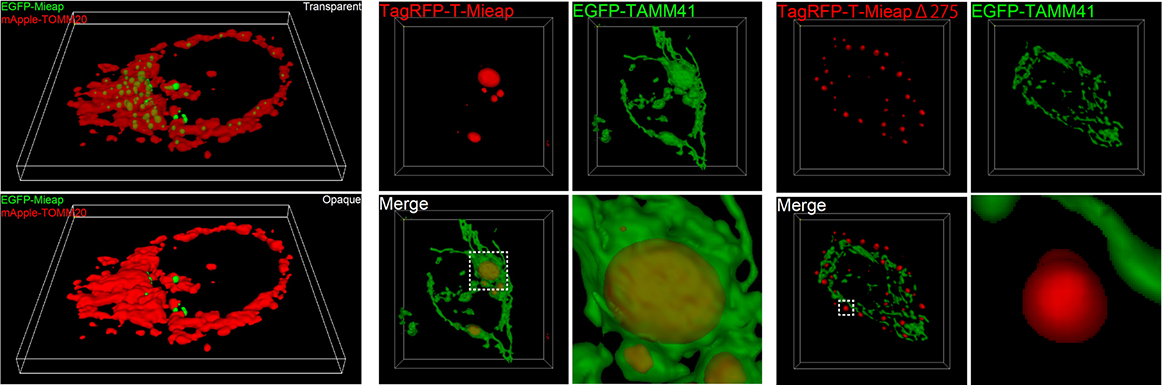
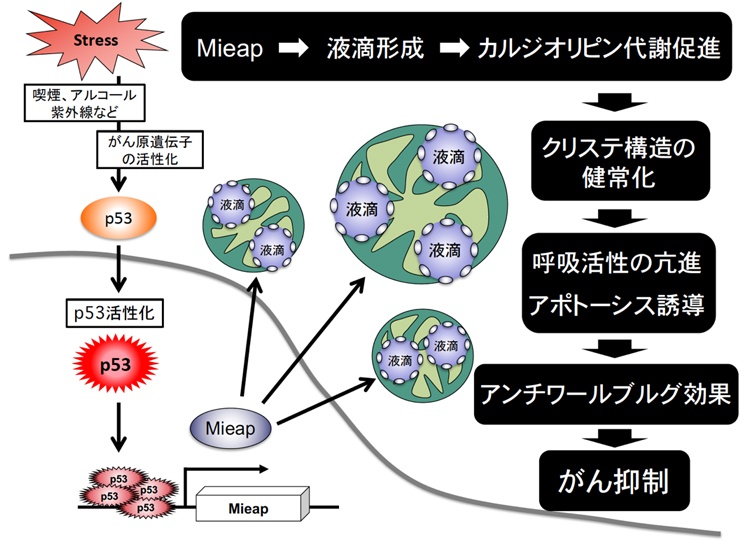
最終的に明らかになった本機能のメカニズムは、Mieapタンパク質がミトコンドリアに液滴(Liquid droplets)を形成し、このMieap液滴が非膜オルガネラ(Membrane-less organelles: MLOs)としてミトコンドリア特異的脂質であるカルジオリピン(Cardiolipin: CL)の代謝反応を区画化し、促進しているというものであった(図2)(iScience 2024)(医学のあゆみ、2022年)。
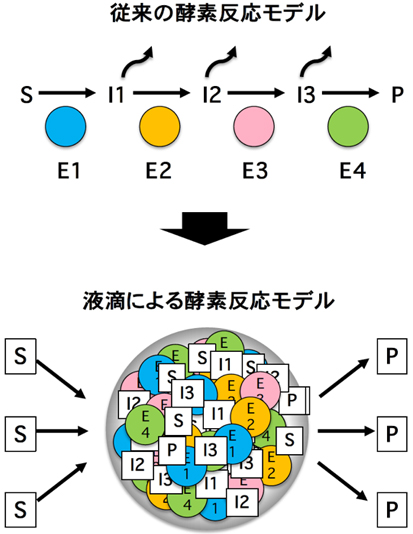
液滴とはタンパク質の濃縮体で、細胞内の環境・条件に応じて、液体との間でその状態を可逆的に変化させることが出来る。重要なことは、この液滴は単なるある単一タンパク質の濃縮状態なのではなく、「数十から数百種類のタンパク質や核酸などの分子を含有した状態」になっており、内部にはある特定の反応に関与する複数の基質と酵素及び反応中間体が濃縮しており、その一連の酵素反応系を促進させる働きを有していることである(図3)。我々が見出したこのMieap液滴は、ミトコンドリア内に形成される液滴で、カルジオリピン代謝の生合成反応とリモデリング反応を促進している非膜オルガネラであった(細胞、2022年)(Droplets of life, 2022年, Elsevier)。
一方でカルジオリピンとは、細胞内で唯一ミトコンドリア固有のリン脂質であり、ミトコンドリアの内膜に存在する(医学のあゆみ、2022年)。カルジオリピンは1分子に4本足の脂肪酸を有しているため極めてユニークな、cone-shapedと呼ばれる、バトミントンのシャトルのような円錐形の形態をとる(図4)。
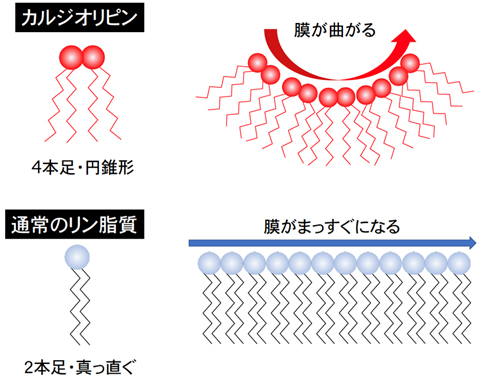
この性質はミトコンドリア内膜クリステの屈曲した形態や構造の構築に重要である(図5)。
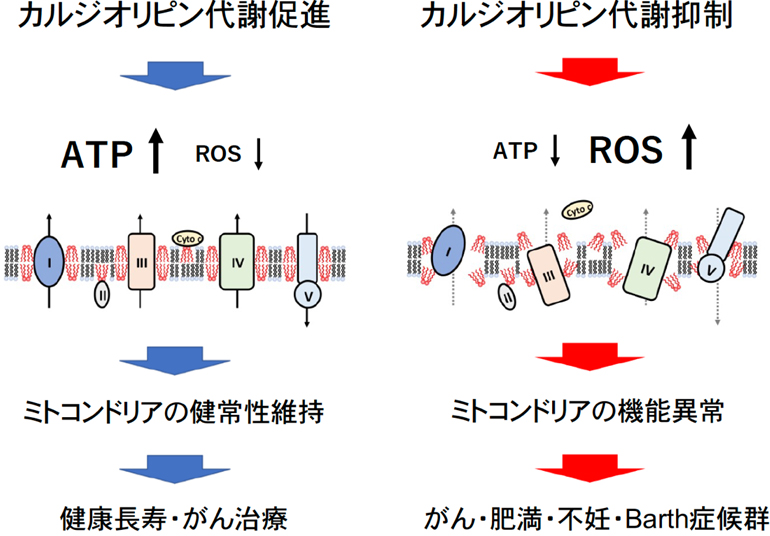
また強く負に荷電した極性頭部と足側の4つの脂肪酸鎖の疎水性結合により、数多くのミトコンドリア膜関連タンパク質と結合し、それらタンパク質の足場となって安定化し機能の発現に重要である。特に呼吸鎖においては複合体I、II、III、IV、Vのそれぞれに対して2分子から4分子のカルジオリピンが結合し、呼吸鎖タンパク質の足場となり各複合体を互いに近接させ、超複合体を形成することで、電子伝達系の効率が高まり、ATP合成活性が上昇するとともに活性酸素種(ROS)の発生が減少する(図6)。逆にカルジオリピンが異常になると、電子伝達系の効率が下がり、ATP合成活性が低下し、ROSの発生が増加する(図6)。
以上より長年不明であったMieapによるミトコンドリア品質管理のメカニズムは、Mieap液滴が非膜オルガネラとしてミトコンドリアでカルジオリピン代謝を促進させることで、カルジオリピンの量的・質的な健常性を維持することと考えられる。この機能はタンパク質分解によるプロテオスタシスやオルガネラ分解によるオートファジーに続く第3のミトコンドリア品質管理機構である。
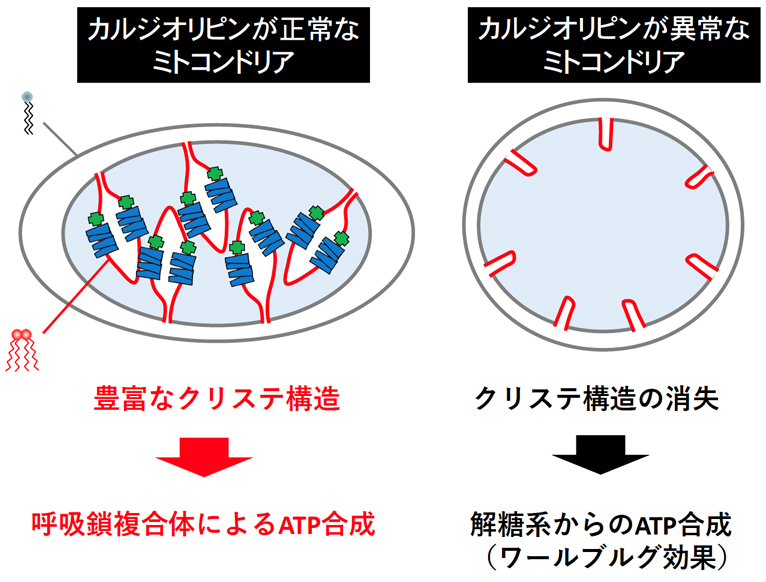
様々ながん種の患者検体を用いた「臨床がんレベルの解析」から、大腸がん・胃がん・乳がんなどのがん組織において、本機能は高頻度に不活性化されていた(Oncogenesis 2016, Cancer Sci 2018, BBRC 2020, Am J Cancer Res 2022)。また「個体レベルの解析」から、Mieap欠損ApcMin/+マウスの小腸及び大腸においては消化管腫瘍の顕著な発生数の増加や腫瘍の悪性化・がん化の著しい促進が認められた(Sci Rep 2015)。さらに、ヒト大腸がん組織とMieap欠損ApcMin/+マウスの腫瘍においては、ともに共通した「球形でクリステ構造が顕著に減少した形態異常を呈するミトコンドリアの集積」を認めた。この形態異常は、カルジオリピン代謝酵素の異常から発症するBarth症候群の患者検体に見られる異常ミトコンドリアに酷似している。
がん細胞ではp53やMieapの破綻によってカルジオリピン代謝抑制が生じ、クリステ構造が減少・消失した異常ミトコンドリアが集積している(図5)(がん分子標的治療、2017年)。がんに特徴的な代謝特性であるワールブルグ効果は、がんのカルジオリピン代謝抑制の結果である可能性がある(医学のあゆみ、2022年)。この「がん細胞特異的に集積した異常ミトコンドリア」が、がんの発生・悪性化・増殖・浸潤・転移におけるdriving forceとして働いていると考えられる。
足場タンパク質であるMieapは単独で非膜オルガネラの形成を駆動でき、生体内でのカルジオリピン代謝活性化が可能になる。我々が世界に先駆けて発見した非膜オルガネラによって制御されるカルジオリピン代謝反応をがん組織で特異的に活性化することで、がんの異常ミトコンドリアを標的としたがんの予防・治療法の開発が可能になると期待される(図6)。